酸性氧化物
混凝土的碱骨料反应是指( )。
A、混凝土内水泥中的酸性氧化物与骨料中的活性SiO2发生化学反应,并在骨料表面生成一层复杂的碱硅酸凝胶
B、混凝土内水泥中的碱性氧化物与骨料中的活性SiO2发生化学反应,并在骨料表面生成一层复杂的碱硅酸凝胶
C、混凝土内水泥中的酸性氧化物与骨料中的活性CO2发生化学反应,并在骨料表面生成一层复杂的碱硅酸凝胶
D、混凝土内水泥中的碱性氧化物与骨料中的活性CO2发生化学反应,并在骨料表面生成一层复杂的碱硅酸凝胶
下列关于酸的化学性质的表述错误的是()。
A.酸能跟酸性氧化物反应生成盐和水
B.酸溶液能跟酸碱指示剂起反应
C.酸能跟多种活泼金属起反应
D.酸跟碱起中和反应生成盐和水
A.SiO2、FeO
B.TiO2、Fe2O3
C.SiO2、NiO2、FeO
D.SiO2、TiO2、Fe2O3
A.FeO、 SiO2
B.TiO2、Fe2O3
C.SiO2、NiO2、FeO
D.SiO2、TiO2、Fe2O3
关于CO2和SiO2的叙述正确的是( ).
A、它们都是IVA族元素最高价氧化物
B、它们都能与NaOH溶液反应
C、它们都是酸性氧化物,溶于水可得到相应的酸
D、它们的物理性质相似
关于氧化物的性质下列()说法是正确的。
A.与水反应生成碱就是碱性氧化物
B.与水反应生成酸的就是酸性氧化物
C.与水反应即可生成酸又可生成碱的叫两性氧化物
D.CO、NO叫不成盐氧化物
A.与水反应生成碱就是碱性氧化物
B.与水反应生成酸的就是酸性氧化物
C.与水反应即可生成酸又可生成碱的叫两性氧化物
D.CO、NO叫不成盐氧化物
A.二氧化硅溶于水显酸性
B.二氧化碳通入水玻璃可得原硅酸
C.因为高温时二氧化硅与碳酸钠反应放出二氧化碳,所以硅酸酸性比碳酸强
D.二氧化硅是酸性氧化物,不溶于任何酸
下列说法正确的是A.亚硫酸溶液中含有亚硫酸、水、二氧化硫三种分子B.用浓盐酸酸化高锰酸钾溶液,可增强高锰酸钾的氧化能力C.铵盐受热都易分解,生成氨和相应的酸D.SiO2是酸性氧化物,能与氢氧化钠溶液反应,不与任何酸反应
下列推断正确的是
A.SiO2是酸性氧化物,能与NaOH溶液反应
B.Na2O、Na2O2组成元素相同,与CO2反应产物也相同
C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
分类方法在化学学科的发展中起到重要的作用。下列分类标准合理的是()。
A、根据氧化物的元素组成,将氧化物分为酸性氧化物和碱性氧化物
B、根据溶液导电能力的强弱,将电解质分为强电解质和弱电解质
C、根据是否具有丁达尔效应,将分散系分为溶液和胶体
D、根据化学反应中物质焓值的变化,将化学反应分为放热反应和吸热反应
推理是化学学习中常用的一种方法。下列推理中,不合理的是()。
A、任何物质导电时,都一定发生了电离过程
B、多数酸性氧化物属于非金属氧化物
C、CO2和NaO2反应产生O2,Na2O2可用于潜艇或航天器中作为O2的来源
D、Fe与CuCl2溶液反应置换出Cu,则可推断Fe金属活泼性比Cu强
2004年,美国科学家通过“勇气”号太空车探测出火星大气中含有一种称为硫化羰的物质(化学式为COS),已知硫化羰与二氧化碳结构相似,但能在氧气中完全燃烧,下列有关硫化羰的说法正确的是()
A、硫化羰可用作灭火剂
B、相同条件下硫化羰的密度比空气大
C、硫化羰在氧气中完全燃烧后生成物是CO2和SO2
D、硫化羰是酸性氧化物
A.硫化羰可用作灭火剂
B.相同条件下硫化羰的密度比空气大
C.硫化羰在氧气中完全燃烧后生成物是CO2和SO2
D.硫化羰是酸性氧化物
SiO2俗称石英砂,是光导纤维的主要成分,下列关于SiO2的有关叙述正确的是()。
A.SiO2是酸性氧化物,它不溶于水也不溶于任何酸
B.SiO2是制造玻璃的主要原料之一,它在常温下不与NaOH溶液反应
C.因高温时SiO2与Na2CO3反应放出CO2,所以H2SiO3酸性比H2CO3强
D.CO2通入水玻璃中可得原硅酸
化学课上,周老师向我们展示了两瓶无标签的溶液,说:“它们分别是稀盐酸和氢氧化钠溶液.请同学们设计不同的方案,然后动手实验,再加以小结.”几分钟后,我们设计了多种方案.(1)我们小组选用了三种不同类别的试剂,分别为:___\_、___\_、______.(2)小雨同学设计了“用二氧化碳气体做试剂”如果要验证NaOH和CO2是否发生了反应,从生成物的角度去探究,可以这样验证(简要写出方法、现象和结论)
方法
现象
结论
__
__
____(3)在上述探究过程中,要注意安全,因为____.
(4)小结时,思静同学说:“碱与酸性氧化物反应生成水”.你还能总结出一条其他规律吗?比如:______.
化学课上,周老师向我们展示了两瓶无标签的溶液,说:“它们分别是稀盐酸和氢氧化钠溶液。请同学们设计不同的方案,然后动手实验,再加以小结。”几分钟后,我们设计了多种方案。⑴我们小组选用了三种不同类别的试剂,分别为:___\__、____\_、_______。⑵小雨同学设计了“用二氧化碳气体做试剂”如果要验证NaOH和CO2是否发生了反应,从生成物的角度去探究,可以这样验证(简要写出方法、现象和结论)

⑶在上述探究过程中,要注意安全,因为___________。⑷小结时,思静同学说:“碱与酸性氧化物反应生成水”。你还能总结出一条其他规律吗?比如:__________________。
甲、乙、丙、丁四种物质转化关系如右图。已知甲是地壳中含量最高的元素组成的单质,化合物乙、丙、丁均含有第三周期一种相同元素。  (1)若乙是难溶于水的酸性氧化物。 ①乙的一种重要用途是
(1)若乙是难溶于水的酸性氧化物。 ①乙的一种重要用途是  ; ②丙溶液中通入少量CO2生成丁的离子方程式是 。 (2)若2乙(g) + 甲(g)
; ②丙溶液中通入少量CO2生成丁的离子方程式是 。 (2)若2乙(g) + 甲(g) 2丙(g),是工业生产中重要反应之一。 恒容条件下,一定量的乙和甲发生反应,不同温度下乙的转化率如下表所示:
2丙(g),是工业生产中重要反应之一。 恒容条件下,一定量的乙和甲发生反应,不同温度下乙的转化率如下表所示:
温度/℃
400
450
500
550
600
650
转化率/%
99.2
97.5
93.5
85.6
73.7
58.5 ①该反应的△H
0(填“>”、“<”或“=”,下同); ②若400℃和500℃的化学平衡常数分别为K1、K2,则K1 K2。 (3)若丙是离子化合物,且阴离子含金属元素R。 ①R的原子结构示意图是 ; ②已知:R(s) +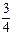 O2(g) =
O2(g) = R2O3(s) △H=-834.8 kJ·mol-1 Mn(s) + O2(g) = MnO2(s) △H=-520.9 kJ·mol-1 写出R的单质与MnO2反应的热化学方程式 。
R2O3(s) △H=-834.8 kJ·mol-1 Mn(s) + O2(g) = MnO2(s) △H=-520.9 kJ·mol-1 写出R的单质与MnO2反应的热化学方程式 。
二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一。 (1)一定条件下,2SO2(g)+O2(g)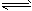 2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和 0.2mol SO3(g),2min后反应达到平衡时,测得SO2的转化率为50%,则该可逆反应的平衡常数K= ___;恒温下,若往容器中再加入2 mol SO2(g),则重新达到平衡时SO2的总转化率_____50%(选填“>”、“<”或“=”)。 (2)用CH4催化还原NOx为N2可以消除氮氧化物的污染。现有1L NO2、NO混合气体NOx,将其还原成 N2,需同温同压下CH4的体积0.4L,则混合气体中NO2、NO的物质量之比为_____。 (3)新型纳米材料氧缺位铁酸盐(ZnFe2Ox),由铁酸盐(ZnFe2O4)经高温还原制得,常温下,它能使工业废气中的酸性氧化物分解除去,转化流程如图所示
2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和 0.2mol SO3(g),2min后反应达到平衡时,测得SO2的转化率为50%,则该可逆反应的平衡常数K= ___;恒温下,若往容器中再加入2 mol SO2(g),则重新达到平衡时SO2的总转化率_____50%(选填“>”、“<”或“=”)。 (2)用CH4催化还原NOx为N2可以消除氮氧化物的污染。现有1L NO2、NO混合气体NOx,将其还原成 N2,需同温同压下CH4的体积0.4L,则混合气体中NO2、NO的物质量之比为_____。 (3)新型纳米材料氧缺位铁酸盐(ZnFe2Ox),由铁酸盐(ZnFe2O4)经高温还原制得,常温下,它能使工业废气中的酸性氧化物分解除去,转化流程如图所示
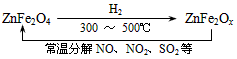
若2mol ZnFe2Ox与SO2可生成0.75 mol S,x=_____。求可分解⑵中混合气体体积V(标准状况下)。(写出计算过程)
