酸性焊条其熔渣的成分主要是酸性氧化物,其中包括()。
A.FeO、 SiO2
B.TiO2、Fe2O3
C.SiO2、NiO2、FeO
D.SiO2、TiO2、Fe2O3
相关标签: 酸性氧化物 氧化物
相关问题推荐
-
关于氧化物的性质下列()说法是正确的。
A.与水反应生成碱就是碱性氧化物
B.与水反应生成酸的就是酸性氧化物
C.与水反应即可生成酸又可生成碱的叫两性氧化物
D.CO、NO叫不成盐氧化物
-
化学课上,周老师向我们展示了两瓶无标签的溶液,说:“它们分别是稀盐酸和氢氧化钠溶液。请同学们设计不同的方案,然后动手实验,再加以小结。”几分钟后,我们设计了多种方案。⑴我们小组选用了三种不同类别的试剂,分别为:___\__、____\_、_______。⑵小雨同学设计了“用二氧化碳气体做试剂”如果要验证NaOH和CO2是否发生了反应,从生成物的角度去探究,可以这样验证(简要写出方法、现象和结论)

⑶在上述探究过程中,要注意安全,因为___________。⑷小结时,思静同学说:“碱与酸性氧化物反应生成水”。你还能总结出一条其他规律吗?比如:__________________。
-
下列叙述中,正确的是( ).
A、凡是含氧的化合物一定是氧化物
B、能电离出氢离子的物质一定是酸
C、能跟酸反应的氧化物,一定是碱性氧化物
D、凡是由金属离子和酸根离子结合而成的物质,一定是盐
-
二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一。 (1)一定条件下,2SO2(g)+O2(g)
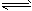 2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和 0.2mol SO3(g),2min后反应达到平衡时,测得SO2的转化率为50%,则该可逆反应的平衡常数K= ___;恒温下,若往容器中再加入2 mol SO2(g),则重新达到平衡时SO2的总转化率_____50%(选填“>”、“<”或“=”)。 (2)用CH4催化还原NOx为N2可以消除氮氧化物的污染。现有1L NO2、NO混合气体NOx,将其还原成 N2,需同温同压下CH4的体积0.4L,则混合气体中NO2、NO的物质量之比为_____。 (3)新型纳米材料氧缺位铁酸盐(ZnFe2Ox),由铁酸盐(ZnFe2O4)经高温还原制得,常温下,它能使工业废气中的酸性氧化物分解除去,转化流程如图所示
2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和 0.2mol SO3(g),2min后反应达到平衡时,测得SO2的转化率为50%,则该可逆反应的平衡常数K= ___;恒温下,若往容器中再加入2 mol SO2(g),则重新达到平衡时SO2的总转化率_____50%(选填“>”、“<”或“=”)。 (2)用CH4催化还原NOx为N2可以消除氮氧化物的污染。现有1L NO2、NO混合气体NOx,将其还原成 N2,需同温同压下CH4的体积0.4L,则混合气体中NO2、NO的物质量之比为_____。 (3)新型纳米材料氧缺位铁酸盐(ZnFe2Ox),由铁酸盐(ZnFe2O4)经高温还原制得,常温下,它能使工业废气中的酸性氧化物分解除去,转化流程如图所示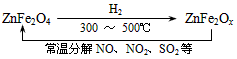
若2mol ZnFe2Ox与SO2可生成0.75 mol S,x=_____。求可分解⑵中混合气体体积V(标准状况下)。(写出计算过程)
-
甲、乙、丙、丁四种物质转化关系如右图。已知甲是地壳中含量最高的元素组成的单质,化合物乙、丙、丁均含有第三周期一种相同元素。
 (1)若乙是难溶于水的酸性氧化物。 ①乙的一种重要用途是
(1)若乙是难溶于水的酸性氧化物。 ①乙的一种重要用途是  ; ②丙溶液中通入少量CO2生成丁的离子方程式是 。 (2)若2乙(g) + 甲(g)
; ②丙溶液中通入少量CO2生成丁的离子方程式是 。 (2)若2乙(g) + 甲(g) 2丙(g),是工业生产中重要反应之一。 恒容条件下,一定量的乙和甲发生反应,不同温度下乙的转化率如下表所示:
2丙(g),是工业生产中重要反应之一。 恒容条件下,一定量的乙和甲发生反应,不同温度下乙的转化率如下表所示: 温度/℃
400
450
500
550
600
650
转化率/%
99.2
97.5
93.5
85.6
73.7
58.5 ①该反应的△H
0(填“>”、“<”或“=”,下同); ②若400℃和500℃的化学平衡常数分别为K1、K2,则K1 K2。 (3)若丙是离子化合物,且阴离子含金属元素R。 ①R的原子结构示意图是 ; ②已知:R(s) +
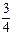 O2(g) =
O2(g) = R2O3(s) △H=-834.8 kJ·mol-1 Mn(s) + O2(g) = MnO2(s) △H=-520.9 kJ·mol-1 写出R的单质与MnO2反应的热化学方程式 。
R2O3(s) △H=-834.8 kJ·mol-1 Mn(s) + O2(g) = MnO2(s) △H=-520.9 kJ·mol-1 写出R的单质与MnO2反应的热化学方程式 。
